Me encuentro con la dificultad de exponer una serie de conceptos sobre la extracción alcohólica de principios activos vegetales y resultar un rollo para algunos/as o bien de escaso interés para otros/as. Intentaré que sea práctico para todos y os ruego una cierta permisividad a los segundos que me visitan. No hay más remedio que dar unas nociones generales y hacer algunas advertencias pues sé que la frontera entre la cosmética y la farmacia se difumina al hablar de la extracción, cuando empleamos alcohol. Me consta un esfuerzo que se está realizando en algún foro para compartir resúmenes de monografías de extracciones alcohólicas y que será enlazado al final de los capítulos necesarios para tener una visión amplia del tema que nos ocupa. Dividiremos el estudio en varias partes que pueden o no coincidir con los capítulos: Generalidades, etanol, graduaciones, tipos de extractos, Farmacopeas y procedimientos y elaboración de tinturas.
 De todos los alcoholes que existen, a nosotros el que más nos interesa, es el Etanol (también llamado alcohol etílico), es el más pequeño después del Metanol y es por eso que resulta de gran utilidad a la hora de disolver (el metanol, que sería otro buen candidato, no nos interesa por ser tóxico, presentando problemas de salud a partir de concentraciones de 200 ppm, los envases presentan el código 6 de tóxicos: la calavera).
De todos los alcoholes que existen, a nosotros el que más nos interesa, es el Etanol (también llamado alcohol etílico), es el más pequeño después del Metanol y es por eso que resulta de gran utilidad a la hora de disolver (el metanol, que sería otro buen candidato, no nos interesa por ser tóxico, presentando problemas de salud a partir de concentraciones de 200 ppm, los envases presentan el código 6 de tóxicos: la calavera).
Los solventes:
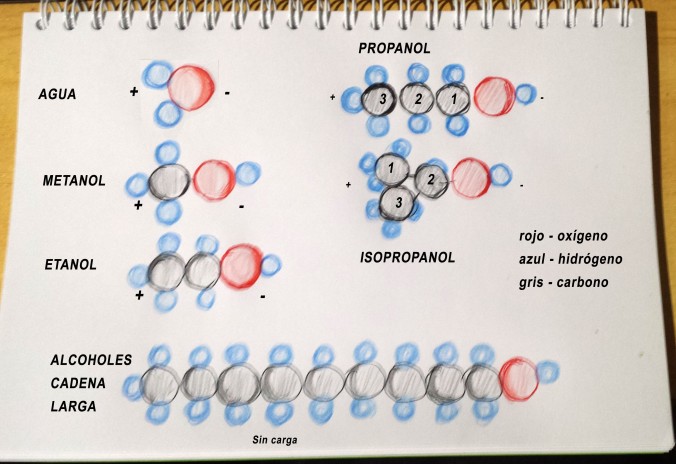
La capacidad que tiene tanto el agua como algunos alcoholes de disolver sustancias semejantes en porque actúan como imanes a la hora de atraer partes del soluto (lo que se disuelve en el líquido) que tienen también su carga, cuando el soluto acaba rodeado por el solvente decimos que la disolución se ha solvatado. El más polar (el imán más potente) es el agua, luego el metanol, luego el etanol, luego el propanol, luego la glicerina, luego el propilenglicol,…por citar los más conocidos.
Todos/as recordamos el dicho: «semejante disuelve semejante» y no hay resumen mejor que exprese la idea de que son necesarios disolventes polares para solutos polares y al contrario, disolventes apolares para solutos apolares, emplearemos por ejemplo gasolina o benceno o cetona para disolver grasas (sustancias apolares), pero nunca emplearíamos agua para disolver parafina. Dentro de este grupo de disolventes orgánicos se encuentran también los alcoholes (¿cómo quedamos entonces? ¿no acabas de escribir lo contrario unas líneas más arriba? estarás pensando) NO EXACTAMENTE. La capacidad que tienen los alcoholes pequeñitos de un solo átomo de carbono o cadenas de 2 o de 3, de actuar como imanes por un lado y de disolver semejantes apolares por otro, le dan un valor excepcional a la hora de extraer lotes de principios activos de los vegetales, esto sin embargo no ocurre con los alcoholes con cadenas largas de carbono.
 Si alguien quiere profundizar en el tema de los disolventes, en tratados de química como en los que pongo en la bibliografía podréis encontrar documentación al respecto (disolventes polares, apolares, solvatación, puentes de hidrógeno, iones, fuerzas de Van der Waals, entropía…)
Si alguien quiere profundizar en el tema de los disolventes, en tratados de química como en los que pongo en la bibliografía podréis encontrar documentación al respecto (disolventes polares, apolares, solvatación, puentes de hidrógeno, iones, fuerzas de Van der Waals, entropía…)
Vayamos pues a conocer a la estrella del artículo: el etanol.
Todos hemos utilizado el etanol en alguna ocasión, generalmente para desinfectar, heridas (¡ como escuece !), utensilios, etc… es un líquido trasparente con un olor característico, volátil y ¡ojo! con una densidad aprox. de 0.8 gr/cm3. Eso quiere decir que más o menos si nadara p.ej. una persona de 64 kilos en una piscina de etanol tendría una mochila de 16 kilos adosada. Esto último es el cálculo para el etanol puro, pero el que nosotros adquirimos normalmente es el que contiene un porcentaje de 95, 63% y en algunos paises el redondeo es por bajo 95% vol y en otros es por alto 96% vol. (En aldelante se indicará sólo los números y dará igual uno u otro)
 Si tienes un trozo sólido de etanol puedo afirmar que estás en un laboratorio o en algún punto del espacio estelar pues se necesitan -118 grados ºC para que esté sólido y permanece líquido desde esa temperatura hasta que llega a los 78,4ºC que pasa de líquido a gaseoso. Esta característica puede sernos de utilidad en un futuro.
Si tienes un trozo sólido de etanol puedo afirmar que estás en un laboratorio o en algún punto del espacio estelar pues se necesitan -118 grados ºC para que esté sólido y permanece líquido desde esa temperatura hasta que llega a los 78,4ºC que pasa de líquido a gaseoso. Esta característica puede sernos de utilidad en un futuro.
Es el momento de romper un mito que he visto muchas veces en la red: algunos/as creen que destilando alcohol de 95 consiguen un alcohol de mayor graduación. Esto es erróneo, cuando se juntan dos líquidos y cada uno de ellos tiene un punto de ebullición diferente (temperatura a la cual el líquido pasa a gaseoso) como puede ser el caso del etanol a 78.4ºC y del agua a 100ºC, el líquido de la unión (azeótropo) puede tener una temperatura de ebullición diferente a cualquiera de ellos y lo normal es que la temperatura de ebullición de la mezcla sea más alta que la del más alto, pero en el caso concreto del etanol con una concentración de 95 y el agua, lo hacen a 78.2 ºC, con lo cual, maldita sea, tu estás destilando alcohol y además destilas agua en una proporción de no llega al 5% y ya puedes repetir el proceso que de ahí no se mueve, porque la temperatura de ebullición del conjunto es un pelo inferior a la del etanol. Para aumentar el grado alcohólico hay que emplear medios químicos pues los físicos (destilación) son inútiles.(Se le añade otro componente para que varíe el punto de ebullición u otros métodos).

Sin indicador y con cloruro de benzalconio
Vamos a parar un instante para hacer una importante advertencia, antes de meternos en las diferentes concentraciones de alcohol que podemos necesitar y que van a ser diluciones en agua destilada del alcohol de más alta concentración que tengamos y que será en la mayoría de los casos de 96. La advertencia viene dada en el fin último que se le vaya a dar a la extracción del principio activo, pues si es un uso tópico no influye en absoluto, pero ingerirlo es otro cantar. El alcohol que podemos encontrar tanto en las farmacias como en los establecimientos de venta de productos químicos de uso doméstico es alcohol etílico (etanol) de 96 pero al que se le ha añadido algún compuesto químico, en muy baja concentración y se trata de sustancias tóxicas, nauseabundas, vomitivas, colorantes o similares. Se le denomina alcohol desnaturalizado o denat. Esta barbaridad se comete para evitar que se pueda emplear este tipo de alcohol para la elaboración de bebidas alcohólicas, pues éstas están gravadas con fuertes impuestos en cualquier país, así, en España, se añade un uno por mil de cloruro de benzalconio, en Colombia, México y Argentina el benzoato de denatonio (bitrex), octoacetato de sacarosa, gasolina, … existen alrededor de 85 desnaturalizantes y en algunos paises se está legislando para excluir algunos de ellos como el metanol.
El precio del etanol natural o de boca, es por tanto muy superior pero es prácticamente obligado utilizarlo si lo que se pretende realizar son algún tipo de preparado alcohólico para ser ingerido. Para uso tópico (en la piel), el porcentaje que se emplea de alcohol es de por sí muy bajo, dado el carácter deshidratante del mismo para aquella, por tanto un 0.1% de un 3% de nuestra crema es insignificante, pero 10 gotas de tintura en tres tomas diarias durante un mes, sería poco prudente. ¿Cómo podemos aprovechar ese enorme potencial que poseen los alcoholes para la extracción en uso tópico? Si el porcentaje que puedo adicionar en una crema es tan pequeño para no resecar la piel, el principio activo también estará en proporciones mínimas…..No es materia de este artículo pero ya os adelanto que las soluciones al problema son extractos HAG y evaporación que se tratará en otra entrada futura.
 Intentar elaborar nuestro propio etanol a partir del zumo de frutas ofrece cierta dificultad (aunque es un proyecto interesante), primero se ha de disponer de suficiente vegetal a un precio económico, cuanta mayor sea la cantidad de azúcar que contenga mejor, como la uva; extraer pues el zumo rico en azúcar, provocar la fermentación (adicionando levadura), evitar la entrada de oxígeno en el recipiente pero permitir la salida de CO2, filtrar cuando cesa la emisión del dióxido, destilar el líquido a 78 grados desechando el 10% inicial que contendría el metanol que es más volátil que el etanol y está presente en nuestra fermentación, y por fin, el resto sería etanol y agua (habría que repetir la destilación de este último para concentrar) y hay que considerar que la reacción enzimática de la levadura que transforma el azúcar en alcohol cesa cuando éste alcanza una proporción de 12%vol que desactiva la enzima y por tanto no esperemos encontrarnos mayor proporción de alcohol en el líquido resultante.
Intentar elaborar nuestro propio etanol a partir del zumo de frutas ofrece cierta dificultad (aunque es un proyecto interesante), primero se ha de disponer de suficiente vegetal a un precio económico, cuanta mayor sea la cantidad de azúcar que contenga mejor, como la uva; extraer pues el zumo rico en azúcar, provocar la fermentación (adicionando levadura), evitar la entrada de oxígeno en el recipiente pero permitir la salida de CO2, filtrar cuando cesa la emisión del dióxido, destilar el líquido a 78 grados desechando el 10% inicial que contendría el metanol que es más volátil que el etanol y está presente en nuestra fermentación, y por fin, el resto sería etanol y agua (habría que repetir la destilación de este último para concentrar) y hay que considerar que la reacción enzimática de la levadura que transforma el azúcar en alcohol cesa cuando éste alcanza una proporción de 12%vol que desactiva la enzima y por tanto no esperemos encontrarnos mayor proporción de alcohol en el líquido resultante.
Una vez consideradas las anteriores cuestiones, veremos en el siguiente capítulo, las concentraciones de alcohol por un lado para la extracción y la concentración del mismo, según las diferentes farmacopeas, del resultado final.
Bibliografía:
Grupo síntesis orgánica Jaume I
National Institute of Standards and Technology. «Standard Reference Material 1828: Ethanol-Water Solutions»
Etanol IICA
Química orgánica moderna W. Griffin
Química orgánica Willian Bonner
 En el capítulo anterior veíamos los diferentes tipos de extracciones y entre ellas destacábamos las tinturas. Las tinturas pueden ser de dos tipos alopáticas u homeopáticas según sean elaboradas para la medicina convencional o lo sean para elaborar productos homeopáticos, a estas segundas se les denomina tinturas madre . La diferencia entre ambas van a ser una preferencia por la droga seca en el primer caso y por la fresca en el segundo, no obstante tanto en un caso como en otro existen excepciones y farmacopeas.
En el capítulo anterior veíamos los diferentes tipos de extracciones y entre ellas destacábamos las tinturas. Las tinturas pueden ser de dos tipos alopáticas u homeopáticas según sean elaboradas para la medicina convencional o lo sean para elaborar productos homeopáticos, a estas segundas se les denomina tinturas madre . La diferencia entre ambas van a ser una preferencia por la droga seca en el primer caso y por la fresca en el segundo, no obstante tanto en un caso como en otro existen excepciones y farmacopeas. Es evidente que recolectaremos el vegetal sano, lejos de zonas industriales o urbanas o con tránsito de vehículos, que no hayan sido tratados con insecticidas, plaguicidas, u otros productos químicos que pudieran alterar sus propiedades ni estar próximos a cultivos que los utilicen. Nos aseguraremos también de que no estamos cometiendo un atentado contra la protección de la especie y ser respetuosos con el medio ambiente. El momento de la recolección es aquel que contenga mayor proporción de principio activo y salvo que en la monografía del vegetal disponga otra cosa recolectaremos:
Es evidente que recolectaremos el vegetal sano, lejos de zonas industriales o urbanas o con tránsito de vehículos, que no hayan sido tratados con insecticidas, plaguicidas, u otros productos químicos que pudieran alterar sus propiedades ni estar próximos a cultivos que los utilicen. Nos aseguraremos también de que no estamos cometiendo un atentado contra la protección de la especie y ser respetuosos con el medio ambiente. El momento de la recolección es aquel que contenga mayor proporción de principio activo y salvo que en la monografía del vegetal disponga otra cosa recolectaremos: El mejor momento del día es por la mañana cuando ya ha desaparecido el rocío pero todavía no esta el sol alto en días sin viento, no obstante hay excepciones y es preciso la recolección a primera hora de la tarde pues por la noche son destruidos los metabólitos secundarios y por la mañana no encontraríamos nada. En el siguiente enlace he encontrado una web ecologista donde da los mejores momentos de recolección por especies vegetales redpermacultura
El mejor momento del día es por la mañana cuando ya ha desaparecido el rocío pero todavía no esta el sol alto en días sin viento, no obstante hay excepciones y es preciso la recolección a primera hora de la tarde pues por la noche son destruidos los metabólitos secundarios y por la mañana no encontraríamos nada. En el siguiente enlace he encontrado una web ecologista donde da los mejores momentos de recolección por especies vegetales redpermacultura Una vez recolectado el vegetal, siguiendo las pautas que comentábamos en el punto anterior, procederemos a un lavado utilizando la menor cantidad de agua posible y someteremos nuestro tesoro a una inspección utilizando los medios ópticos a nuestro alcance para eliminar aquellos que no presenten un aspecto sano y vigoroso y por supuesto todo aquello que no sea el vegetal, partículas extrañas, insectos, arácnidos, otros vegetales …
Una vez recolectado el vegetal, siguiendo las pautas que comentábamos en el punto anterior, procederemos a un lavado utilizando la menor cantidad de agua posible y someteremos nuestro tesoro a una inspección utilizando los medios ópticos a nuestro alcance para eliminar aquellos que no presenten un aspecto sano y vigoroso y por supuesto todo aquello que no sea el vegetal, partículas extrañas, insectos, arácnidos, otros vegetales … Recolectado el vegetal para su uso inmediato (tinturas madre) se procederá a su trituración mediante cuchillas o a su expresión con prensa mecánica para la extracción del jugo. Para la farmacopea convencional el vegetal seco se pulverizará mediante molido (salvo que el calor generado por la maquinaria no fuera adecuado para la especie) y obtención así de un grano que será de fino a mediano empleándose para ello tamices de 40 a 60 µm (si recordáis el artículo de la filtración , el ojo humano alcanza a ver 100µm, allí también se habla del porqué de la pulverización), no obstante cada monografía nos dará un tamaño suficiente.
Recolectado el vegetal para su uso inmediato (tinturas madre) se procederá a su trituración mediante cuchillas o a su expresión con prensa mecánica para la extracción del jugo. Para la farmacopea convencional el vegetal seco se pulverizará mediante molido (salvo que el calor generado por la maquinaria no fuera adecuado para la especie) y obtención así de un grano que será de fino a mediano empleándose para ello tamices de 40 a 60 µm (si recordáis el artículo de la filtración , el ojo humano alcanza a ver 100µm, allí también se habla del porqué de la pulverización), no obstante cada monografía nos dará un tamaño suficiente. Quiero recordar de nuevo el tema del empleo de alcohol no desnaturalizado (de boca). También comentar que todo el conjunto de procedimientos que estamos describiendo y que por supuesto son extraordinariamente precisos cuando se realizan en laboratorios o empresas farmacéuticas (controles que pueden ser mecanizados y controlados por células, secado con sus procesos de inhibición enzimática, radiación, trituración, adecuación alcohólica, extracción, envasado…) es lo que se denomina estandarización y constituye el valor de la tintura. Esta web de cosmética casera pretende aportar, en la medida de lo posible, conocimientos para evitar errores y conseguir productos más fiables, pero en ningún caso sustituir a los profesionales.
Quiero recordar de nuevo el tema del empleo de alcohol no desnaturalizado (de boca). También comentar que todo el conjunto de procedimientos que estamos describiendo y que por supuesto son extraordinariamente precisos cuando se realizan en laboratorios o empresas farmacéuticas (controles que pueden ser mecanizados y controlados por células, secado con sus procesos de inhibición enzimática, radiación, trituración, adecuación alcohólica, extracción, envasado…) es lo que se denomina estandarización y constituye el valor de la tintura. Esta web de cosmética casera pretende aportar, en la medida de lo posible, conocimientos para evitar errores y conseguir productos más fiables, pero en ningún caso sustituir a los profesionales.